Câu hỏi: Đốt cháy hoàn toàn 3,96 g chất hữu cơ A, thu được 1,792 lít CO2 (đktc) và 1,440 g H2O. Nếu chuyển hết lượng clo có trong 2,475 g chất A thành AgCl thì thu được 7,175 g AgCl.
1. Xác định công thức đơn giản nhất của A.
2. Xác định công thức phân tử của A biết rằng tỉ khối hơi của A đối với etan là 3,3.
3. Viết các công thức cấu tạo mà A có thể có và ghi tên từng chất theo hai cách đọc tên khác nhau.
1. Xác định công thức đơn giản nhất của A.
2. Xác định công thức phân tử của A biết rằng tỉ khối hơi của A đối với etan là 3,3.
3. Viết các công thức cấu tạo mà A có thể có và ghi tên từng chất theo hai cách đọc tên khác nhau.
Phương pháp giải
1. +) Tìm mC, mH, mCl, mO(nếu có) từ đó xác định thành phần các nguyên tố trong A
+) Tìm tỉ lệ các nguyên tố trong A \(\to\) CTĐGN của A.
2. Tìm khối lượng phân tử A dựa vào tỉ khối hơi \(\to\) CTPT cần tìm của A.
3. Viết CTCT và gọi tên A.
Lời giải chi tiết
1. Khi đốt cháy A ta thu được CO2 và H2O; vậy A phải chứa C và H.
Khối lượng C trong 1,792 lít CO2 là : \(\dfrac{{12.1,792}}{{22,4}}\) = 0,96 (g).
Khối lượng H trong 1,44 g H2O : \(\dfrac{{2.1,44}}{{18}}\) = 0,16 (g).
Đó cũng là khối lượng C và H trong 3,96 g A.
Theo đầu bài A phải chứa Cl. Khối lượng Cl trong 7,175 g AgCl :
\(\dfrac{{35,5.7,175}}{{143,5}} = 1,775(g)\)
Đó cũng là khối lượng Cl trong 2,475 g A.
Vậy, khối lượng Cl trong 3,96 g A : \(\dfrac{{1,775.3,96}}{{2,475}}\) = 2,840 (g).
Khối lượng C, H và Cl đúng bằng khối lượng chất A (3,96 g).
Vậy, chất A có dạng CxHyClz.
x : y : z = \(\dfrac{{0,96}}{{12}}:\dfrac{{0,16}}{1}:\dfrac{{2,84}}{{35,5}}\) = 0,08 : 0,16 : 0,08 = 1 : 2 : 1
CTĐGN của A là CH2Cl.
2. MA = 3,3.30 = 99 (g/mol)
\(\Rightarrow {(C{H_2}Cl)_n}\) = 99 \(\Rightarrow \) 49,5n = 99 \(\Rightarrow \) n = 2
CTPT của A là C2H4Cl2.
3. Các CTCT
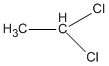 1,1-đicloetan
1,1-đicloetan
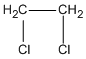 1,2-đicloetan (etylen clorua)
1,2-đicloetan (etylen clorua)
1. +) Tìm mC, mH, mCl, mO(nếu có) từ đó xác định thành phần các nguyên tố trong A
+) Tìm tỉ lệ các nguyên tố trong A \(\to\) CTĐGN của A.
2. Tìm khối lượng phân tử A dựa vào tỉ khối hơi \(\to\) CTPT cần tìm của A.
3. Viết CTCT và gọi tên A.
Lời giải chi tiết
1. Khi đốt cháy A ta thu được CO2 và H2O; vậy A phải chứa C và H.
Khối lượng C trong 1,792 lít CO2 là : \(\dfrac{{12.1,792}}{{22,4}}\) = 0,96 (g).
Khối lượng H trong 1,44 g H2O : \(\dfrac{{2.1,44}}{{18}}\) = 0,16 (g).
Đó cũng là khối lượng C và H trong 3,96 g A.
Theo đầu bài A phải chứa Cl. Khối lượng Cl trong 7,175 g AgCl :
\(\dfrac{{35,5.7,175}}{{143,5}} = 1,775(g)\)
Đó cũng là khối lượng Cl trong 2,475 g A.
Vậy, khối lượng Cl trong 3,96 g A : \(\dfrac{{1,775.3,96}}{{2,475}}\) = 2,840 (g).
Khối lượng C, H và Cl đúng bằng khối lượng chất A (3,96 g).
Vậy, chất A có dạng CxHyClz.
x : y : z = \(\dfrac{{0,96}}{{12}}:\dfrac{{0,16}}{1}:\dfrac{{2,84}}{{35,5}}\) = 0,08 : 0,16 : 0,08 = 1 : 2 : 1
CTĐGN của A là CH2Cl.
2. MA = 3,3.30 = 99 (g/mol)
\(\Rightarrow {(C{H_2}Cl)_n}\) = 99 \(\Rightarrow \) 49,5n = 99 \(\Rightarrow \) n = 2
CTPT của A là C2H4Cl2.
3. Các CTCT