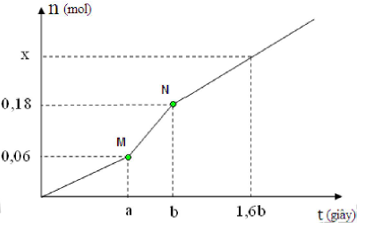
Câu hỏi: Hòa tan hoàn toàn m gam hỗn hợp NaCl và Cu(NO3)2 vào nước, thu được dung dịch X. Tiến hành điện phân X với các điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số mol khí thu được trên cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị bên (đồ thị gấp khúc tại các điểm M, N). Giả sử hiệu suất điện phân là 100%, bỏ qua sự bay hơi của nước.
Cho các kết luận liên quan đến bài toán gồm:
(1) Kết thúc điện phân, thể tích khí thu được tại catot là 6,4512 lít (đktc).
(2) Tỉ số b: a có giá trị bằng 2 :1.
(3) Giá trị của m là 25,32 gam.
(4) Dung dịch sau điện phân hòa tan tối đa 3,24 gam Al kim loại. Số kết luận đúnglà
A. $3~$
B. $2$
C. $1$
D. $4$.

Cho các kết luận liên quan đến bài toán gồm:
(1) Kết thúc điện phân, thể tích khí thu được tại catot là 6,4512 lít (đktc).
(2) Tỉ số b: a có giá trị bằng 2 :1.
(3) Giá trị của m là 25,32 gam.
(4) Dung dịch sau điện phân hòa tan tối đa 3,24 gam Al kim loại. Số kết luận đúnglà
A. $3~$
B. $2$
C. $1$
D. $4$.
Phương pháp:
Thứ tự xảy ra điện phân là
Tại A(+) $2\text{C}{{\text{l}}^{-}}\to \text{C}{{\text{l}}_{2}}+2\text{e}$
$2{{\text{H}}_{2}}\text{O}\to 4{{\text{H}}^{+}}+4\text{e}+{{\text{O}}_{2}}$
Tại K(-) $\text{C}{{\text{u}}^{+2}}+2\text{e}\to \text{Cu}$
$2{{\text{H}}_{2}}\text{O}+2\text{e}\to {{\text{H}}_{2}}+2\text{O}{{\text{H}}^{-}}$
+ Giai đoạn (1) chỉ có điện phân tạo khí tại anot
+ Giai đoạn (2) đồ thị lên nhanh nên có điện phân tạo khí ở cả 2 cực với cực A là điện phân Cl- và K là điện phân H2O
+ Giai đoạn (3) đồ thị đi lên nhưng chậm hơn giai đoạn 2 $\Rightarrow $ điện phân nước ở cả hai cực Xét từng giai đoạn tìm số mol khí thoát ra từng giai đoạn
Bảo toàn nguyên tố
Hướng dẫn giải:
PTHH :
Thứ tự xảy ra điện phân là
Tại A(+): $2\text{C}{{\text{l}}^{-}}\to \text{C}{{\text{l}}_{2}}+2\text{e}$
$2{{\text{H}}_{2}}\text{O}\to 4{{\text{H}}^{+}}+4\text{e}+{{\text{O}}_{2}}$
Tại K(-): $\text{C}{{\text{u}}^{+2}}+2\text{e}\to \text{Cu}$
$2{{\text{H}}_{2}}\text{O}+2\text{e}\to {{\text{H}}_{2}}+2\text{O}{{\text{H}}^{-}}$
+ Giai đoạn (1) chỉ có điện phân tạo khí tại anot
+ Giai đoạn (2) đồ thị lên nhanh nên có điện phân tạo khí ở cả 2 cực với cực A là điện phân Cl- và K là điện phân H2O
+ Giai đoạn (3) đồ thị đi lên nhưng chậm hơn giai đoạn 2 điện phân nước ở cả hai cực
*Xét giai đoạn (1) t1 $=\left[ 0;a \right]:$ Chỉ sinh ra khí Cl2
$\Rightarrow {{n}_{\text{Cl}2(1)}}=0,06\text{mol}\Rightarrow {{n}_{C(1)}}=2{{n}_{\text{Cl}2(1)}}=0,12\text{mol}$
*Xét giai đoạn (2) t2 =[a; b]: Sinh ra thêm khí Cl2, H2
nkhí tăng thêm = nCl2(2) + nH2(2) = 0,18 - 0,06 = 0,12 mol
Catot: H2O+le → 0,5 H2 + OH-
Anot: Cl- → 0,5 Cl2 + le
Theo bảo toàn e thì: nC12(2) = nH2(2) = 0,12/2=0,06 mol
$\Rightarrow $ ne(2) = 2nH2(2) = 0,06.2 = 0,12 (mol).
Vì ng tỉ lệ thuận với t nên ta có:
$\dfrac{{{t}_{1}}}{{{t}_{2}}}=\dfrac{{{n}_{e\left( 1 \right)}}}{{{n}_{e(2)}}}\to \dfrac{a-0}{b-a}=\dfrac{0,12}{0,12}\to 2a=b$
*Xét giai đoạn (3) t3 = [b; 1,6b] điện phân nước ở cả hai cực thì:
Ta có. $\dfrac{{{t}_{3}}}{{{t}_{2}}}=\dfrac{1,6b-b}{b-a}=\dfrac{0,6b}{b-a}=\dfrac{0,6b}{b-\dfrac{1}{2}b}=1,2$
-
-
Vì ne tỉ lệ thuận với t nên ta có: $\dfrac{{{t}_{3}}}{{{t}_{2}}}=\dfrac{{{n}_{c(3)}}}{{{n}_{e(2)}}}=1,2\to {{n}_{e(3)}}=1,2.{{n}_{e(2)}}=1,2.0,12=0,144(\text{mol})$
Catot: ${{\text{H}}_{2}}\text{O}+1\text{e}\to 0,5{{\text{H}}_{2}}+\text{O}{{\text{H}}^{-}}$
0,144 → 0,072 (mol)
Anot: H2O → 2H+0,5 O2 + 2e
0,036 ← 0,144 (mol)
$\Rightarrow \text{x}=0,18+\text{n}{{\text{o}}_{2(3)}}+{{\text{n}}_{\text{H}2(3)}}=0,18+0,036+0,072=0,288 \text{mol}$
(1) sai vì tại catot thì: nkhí = nH212) + nH2(3) = 0,06 + 0,072 = 0,132 mol $\Rightarrow $ V=2,9568 mol
(2) đúng
(3) đúng
Bảo toàn $\text{Cl}\Rightarrow {{\text{n}}_{\text{NaCl}}}=2{{\text{n}}_{\text{Cl}}}_{2(1)}+2{{\text{n}}_{\text{Cl2}(2)}}=2.0,06+2.0,06=0,24\text{mol}$
Bảo toàn $\text{Cu}\Rightarrow {{\text{n}}_{\text{Cu}(\text{NO}3)2}}={{\text{n}}_{\text{Cu}(\text{l})}}=0,06\text{mol}$
$\Rightarrow \text{m}=0,06.188+0,24.58,5=25,32$ gam
(4) đúng
Dung dịch sau điện phân có chứa: $\text{N}{{\text{a}}^{+}}(0,24\text{mol});\text{N}{{\text{O}}_{\text{3}}}^{-}(0,12\text{mol})\text{ v }\!\!\grave{\mathrm{a}}\!\!\text{ O}{{\text{H}}^{-}}$
Bảo toàn điện tích $\Rightarrow {{n}_{OH-}}=0,12mol$
Ta có: $2\text{O}{{\text{H}}^{-}}+2\text{Al}+2{{\text{H}}_{2}}\text{O}\to 2\text{Al}{{\text{O}}_{\text{2}}}^{-}+3{{\text{H}}_{2}}$
0,12 → 0,12
mAl = 3,24 gam
Vậy có 3 kết luận đúng (2)(3)(4).
Thứ tự xảy ra điện phân là
Tại A(+) $2\text{C}{{\text{l}}^{-}}\to \text{C}{{\text{l}}_{2}}+2\text{e}$
$2{{\text{H}}_{2}}\text{O}\to 4{{\text{H}}^{+}}+4\text{e}+{{\text{O}}_{2}}$
Tại K(-) $\text{C}{{\text{u}}^{+2}}+2\text{e}\to \text{Cu}$
$2{{\text{H}}_{2}}\text{O}+2\text{e}\to {{\text{H}}_{2}}+2\text{O}{{\text{H}}^{-}}$
+ Giai đoạn (1) chỉ có điện phân tạo khí tại anot
+ Giai đoạn (2) đồ thị lên nhanh nên có điện phân tạo khí ở cả 2 cực với cực A là điện phân Cl- và K là điện phân H2O
+ Giai đoạn (3) đồ thị đi lên nhưng chậm hơn giai đoạn 2 $\Rightarrow $ điện phân nước ở cả hai cực Xét từng giai đoạn tìm số mol khí thoát ra từng giai đoạn
Bảo toàn nguyên tố
Hướng dẫn giải:
PTHH :
Thứ tự xảy ra điện phân là
Tại A(+): $2\text{C}{{\text{l}}^{-}}\to \text{C}{{\text{l}}_{2}}+2\text{e}$
$2{{\text{H}}_{2}}\text{O}\to 4{{\text{H}}^{+}}+4\text{e}+{{\text{O}}_{2}}$
Tại K(-): $\text{C}{{\text{u}}^{+2}}+2\text{e}\to \text{Cu}$
$2{{\text{H}}_{2}}\text{O}+2\text{e}\to {{\text{H}}_{2}}+2\text{O}{{\text{H}}^{-}}$
+ Giai đoạn (1) chỉ có điện phân tạo khí tại anot
+ Giai đoạn (2) đồ thị lên nhanh nên có điện phân tạo khí ở cả 2 cực với cực A là điện phân Cl- và K là điện phân H2O
+ Giai đoạn (3) đồ thị đi lên nhưng chậm hơn giai đoạn 2 điện phân nước ở cả hai cực
*Xét giai đoạn (1) t1 $=\left[ 0;a \right]:$ Chỉ sinh ra khí Cl2
$\Rightarrow {{n}_{\text{Cl}2(1)}}=0,06\text{mol}\Rightarrow {{n}_{C(1)}}=2{{n}_{\text{Cl}2(1)}}=0,12\text{mol}$
*Xét giai đoạn (2) t2 =[a; b]: Sinh ra thêm khí Cl2, H2
nkhí tăng thêm = nCl2(2) + nH2(2) = 0,18 - 0,06 = 0,12 mol
Catot: H2O+le → 0,5 H2 + OH-
Anot: Cl- → 0,5 Cl2 + le
Theo bảo toàn e thì: nC12(2) = nH2(2) = 0,12/2=0,06 mol
$\Rightarrow $ ne(2) = 2nH2(2) = 0,06.2 = 0,12 (mol).
Vì ng tỉ lệ thuận với t nên ta có:
$\dfrac{{{t}_{1}}}{{{t}_{2}}}=\dfrac{{{n}_{e\left( 1 \right)}}}{{{n}_{e(2)}}}\to \dfrac{a-0}{b-a}=\dfrac{0,12}{0,12}\to 2a=b$
*Xét giai đoạn (3) t3 = [b; 1,6b] điện phân nước ở cả hai cực thì:
Ta có. $\dfrac{{{t}_{3}}}{{{t}_{2}}}=\dfrac{1,6b-b}{b-a}=\dfrac{0,6b}{b-a}=\dfrac{0,6b}{b-\dfrac{1}{2}b}=1,2$
-
-
Vì ne tỉ lệ thuận với t nên ta có: $\dfrac{{{t}_{3}}}{{{t}_{2}}}=\dfrac{{{n}_{c(3)}}}{{{n}_{e(2)}}}=1,2\to {{n}_{e(3)}}=1,2.{{n}_{e(2)}}=1,2.0,12=0,144(\text{mol})$
Catot: ${{\text{H}}_{2}}\text{O}+1\text{e}\to 0,5{{\text{H}}_{2}}+\text{O}{{\text{H}}^{-}}$
0,144 → 0,072 (mol)
Anot: H2O → 2H+0,5 O2 + 2e
0,036 ← 0,144 (mol)
$\Rightarrow \text{x}=0,18+\text{n}{{\text{o}}_{2(3)}}+{{\text{n}}_{\text{H}2(3)}}=0,18+0,036+0,072=0,288 \text{mol}$
(1) sai vì tại catot thì: nkhí = nH212) + nH2(3) = 0,06 + 0,072 = 0,132 mol $\Rightarrow $ V=2,9568 mol
(2) đúng
(3) đúng
Bảo toàn $\text{Cl}\Rightarrow {{\text{n}}_{\text{NaCl}}}=2{{\text{n}}_{\text{Cl}}}_{2(1)}+2{{\text{n}}_{\text{Cl2}(2)}}=2.0,06+2.0,06=0,24\text{mol}$
Bảo toàn $\text{Cu}\Rightarrow {{\text{n}}_{\text{Cu}(\text{NO}3)2}}={{\text{n}}_{\text{Cu}(\text{l})}}=0,06\text{mol}$
$\Rightarrow \text{m}=0,06.188+0,24.58,5=25,32$ gam
(4) đúng
Dung dịch sau điện phân có chứa: $\text{N}{{\text{a}}^{+}}(0,24\text{mol});\text{N}{{\text{O}}_{\text{3}}}^{-}(0,12\text{mol})\text{ v }\!\!\grave{\mathrm{a}}\!\!\text{ O}{{\text{H}}^{-}}$
Bảo toàn điện tích $\Rightarrow {{n}_{OH-}}=0,12mol$
Ta có: $2\text{O}{{\text{H}}^{-}}+2\text{Al}+2{{\text{H}}_{2}}\text{O}\to 2\text{Al}{{\text{O}}_{\text{2}}}^{-}+3{{\text{H}}_{2}}$
0,12 → 0,12
mAl = 3,24 gam
Vậy có 3 kết luận đúng (2)(3)(4).
Đáp án A.