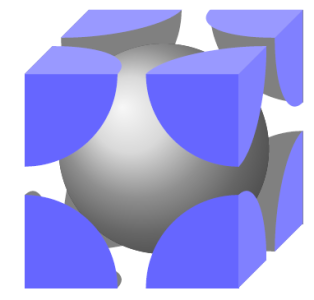
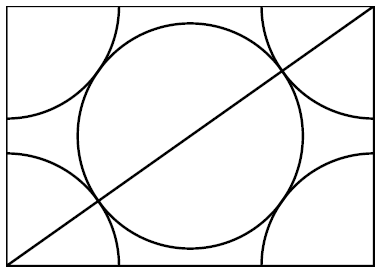
Câu hỏi: Crôm ( ${Cr}$ ) có cấu trúc tinh thể lập phương tâm khối, mỗi nguyên tử ${Cr}$ có hình dạng cầu với bán kính ${R}$. Một ô cơ sở của mạng tinh thể ${Cr}$ là một hình lập phương có cạnh bằng ${a}$, chứa một nguyên tử ${Cr}$ ở chính giữa và mỗi góc chứa ${\dfrac{1}{8}}$ nguyên tử ${Cr}$ khác (Hình a), (Hình b mô tả thiết diện của ô cơ sở nói trên với mặt chéo của nó).
A. ${32\%}$.
B. ${46\%}$.
C. ${18\%}$.
D. ${54\%}$.
Thể tích của ô cơ sở là ${V=a^3=\dfrac{64R^3}{3\sqrt{3}}}$.
Thể tích ${Cr}$ chiếm chỗ trong ô cơ sở là ${V_1=2V_{Cr}=\dfrac{8\pi R^3}{3}}$.
Độ đặc khít của ${Cr}$ là ${\dfrac{V_1}{V}\cdot 100\% \approx 68\%}$ nên tỉ lệ lỗ trống là ${32\%}$.


Hình a &Hình b
Độ đặc khít của ${Cr}$ trong một ô cơ sở là tỉ lệ ${\%}$ thể tích mà ${Cr}$ chiếm chỗ trong ô cơ sở đó. Tỉ lệ lỗ trống trong một ô cơ sở làA. ${32\%}$.
B. ${46\%}$.
C. ${18\%}$.
D. ${54\%}$.
Độ dài đường chéo của ô cơ sở là ${4R}$. Gọi cạnh của ô cơ sở là ${a}$, ta có ${3a^2=(4R)^2 \Leftrightarrow a=\dfrac{4R}{\sqrt{3}}}$.Thể tích của ô cơ sở là ${V=a^3=\dfrac{64R^3}{3\sqrt{3}}}$.
Thể tích ${Cr}$ chiếm chỗ trong ô cơ sở là ${V_1=2V_{Cr}=\dfrac{8\pi R^3}{3}}$.
Độ đặc khít của ${Cr}$ là ${\dfrac{V_1}{V}\cdot 100\% \approx 68\%}$ nên tỉ lệ lỗ trống là ${32\%}$.
Đáp án A.