Câu hỏi: Thêm nước vào 10,0 ml axit axetic băng (axit 100%, \(D = 1,05g/c{m^3}\)) đến thể tích 1,75 lít ở \({25^o}C\) rồi dùng máy đo thì thấy pH = 2,9.
a) Tính nồng độ mol của dung dịch thu được
b) Tính độ điện li \(\alpha \) của axit axetics ở dung dịch nói trên
c) Tính gần đúng hằng số cân bằng của axit axetic ở \({25^o}C\)
a) Tính nồng độ mol của dung dịch thu được
b) Tính độ điện li \(\alpha \) của axit axetics ở dung dịch nói trên
c) Tính gần đúng hằng số cân bằng của axit axetic ở \({25^o}C\)
Lời giải chi tiết
a) Số mol \(C{H_3}{\rm{COO}}H:n = {{C\% . D. V} \over {100. M}} = 0,175mol\)
Nồng độ mol/l của \(C{H_3}{\rm{COO}}H\) trong dung dịch: \({C_M} = {{0,175} \over {1,75}} = 0,1M\)
b) pH = 2,9 \(\Rightarrow {\rm{[}}{H^ + }{\rm{] = 1}}{{\rm{0}}^{ - 2,9}}M\)
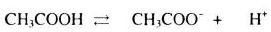
Trước điện li: 0,1 0 0
Điện li: \(0,1\alpha \) \(\to \) \(0,1\alpha \) \(\to \) \(0,1\alpha \)
Sau điện li: (0,1-\(0,1\alpha \)) \(0,1\alpha \) \(0,1\alpha \)
Ta có \(0,1\alpha = {10^{ - 2,9}} \Rightarrow \alpha = {10^{ - 1,9}}\)
\({K_a} = {{\left[ {C{H_3}{\rm{CO}}{{\rm{O}}^ - }} \right]\left[ {{H^ + }} \right]} \over {\left[ {C{H_3}{\rm{COO}}H} \right]}} = {{0,1\alpha. 0,1\alpha } \over {0,1.(1 - \alpha)}}\)
Vì \(\alpha < < 1 \Rightarrow 0,1.(1 - \alpha) \approx 0,1 \)
\(\Rightarrow {K_a} = 0,1{\alpha ^2} = 0,{1.10^{ - 3,8}} = {10^{ - 4,8}}\)
a) Số mol \(C{H_3}{\rm{COO}}H:n = {{C\% . D. V} \over {100. M}} = 0,175mol\)
Nồng độ mol/l của \(C{H_3}{\rm{COO}}H\) trong dung dịch: \({C_M} = {{0,175} \over {1,75}} = 0,1M\)
b) pH = 2,9 \(\Rightarrow {\rm{[}}{H^ + }{\rm{] = 1}}{{\rm{0}}^{ - 2,9}}M\)
Trước điện li: 0,1 0 0
Điện li: \(0,1\alpha \) \(\to \) \(0,1\alpha \) \(\to \) \(0,1\alpha \)
Sau điện li: (0,1-\(0,1\alpha \)) \(0,1\alpha \) \(0,1\alpha \)
Ta có \(0,1\alpha = {10^{ - 2,9}} \Rightarrow \alpha = {10^{ - 1,9}}\)
\({K_a} = {{\left[ {C{H_3}{\rm{CO}}{{\rm{O}}^ - }} \right]\left[ {{H^ + }} \right]} \over {\left[ {C{H_3}{\rm{COO}}H} \right]}} = {{0,1\alpha. 0,1\alpha } \over {0,1.(1 - \alpha)}}\)
Vì \(\alpha < < 1 \Rightarrow 0,1.(1 - \alpha) \approx 0,1 \)
\(\Rightarrow {K_a} = 0,1{\alpha ^2} = 0,{1.10^{ - 3,8}} = {10^{ - 4,8}}\)