Câu hỏi: 1. Thí nghiệm 1: Điều chế và chứng minh tính khử của hidro sunfua
- Tiến hành TN:
+ Lắp dụng cụ điều chế H2S từ FeS và HCl như hình vẽ
+ Đốt khí H2S thoát ra từ ống vuốt nhọn.
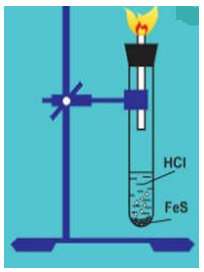
- Hiện tượng: Có bọt khí mùi trứng thối thoát ra. Đốt khí thoát ra thấy cháy trong không khí cho ngọn lửa màu xanh.
PTHH: FeS + 2HCl → FeCl2 + H2S
2H2S + O2 → 2S + 2H2O
H2S: là chất khử
O2: là chất oxi hóa.
- Giải thích: H2S bị oxi hóa trong khí bởi oxi.
2. Thí nghiệm 2: Điều chế và chứng minh tính chất hóa học của lưu huỳnh đioxit
- Tiến hành TN: Lắp dụng cụ điều chế SO2 từ Na2SO3 và dung dịch H2SO4 như hình vẽ
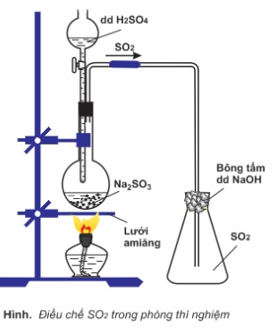
+ Thí nghiệm chứng minh tính khử: Dẫn khí SO2 vào ống 1 chứa dung dịch KMnO4 loãng
+ Thí nghiệm chứng minh tính oxi hóa: Dẫn khí H2S (điều chế ở TN1) vào ống 2 chứa nước được dd H2S.
Sau đó dẫn khí SO2 và dd H2S.
- Hiện tượng:
+ Ống 1: Khí SO2 làm mất màu thuốc tím.
PTHH: 2KMnO4 + 5SO2 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4
KMnO4: chất oxi hóa
SO2: chất khử
+ Ống 2: Có hiện tượng vẩn đục, màu vàng do phản ứng tạo S.
PTHH: SO2 + H2S → 3S + 2H2O
SO2: chất oxi hóa
H2S: chất khử
- Giải thích:
SO2 vừa thể hiện tính khử vừa thể hiện tính oxi hóa.
3. Thí nghiệm 3: Tính oxi hóa và tính háo nước của axit sunfuric đặc.
- Tiến hành TN:
+ Thí nghiệm thể hiện tính oxi hóa: Nhỏ vài giọt H2SO4 đặc vào ống 1, cho tiếp 1 mảnh Cu vào ống nghiệm, đun nóng nhẹ trên ngọn lửa đèn cồn.
+ Thí nghiệm thể hiện tính háo nước: Cho 1 thìa nhỏ đường vào ống 2. Nhỏ vài giọt H2SO4 đặc vào ống nghiệm

- Hiện tượng:
+ Ống 1: dung dịch có bọt khí và từ không màu chuyển sang màu xanh.
PTHH: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Cu: là chất khử
H2SO4 đặc: là chất oxi hóa
+ Ống 2: Phản ứng tạo chất rắn màu đen không tan là cacbon, có hiện tượng sủi bọt khí trào ra do C bị oxi hóa bởi H2SO4 đặc tạo CO¬2 và SO2
PTHH: C12H22O11 -H2SO4đặc→ 11H2O + 12C
C + 2H2SO4 → CO2 + 2SO2 + 2H2O
C: chất khử
H2SO4: chất oxi hóa
- Giải thích: H2SO4 đặc có tính oxi hóa mạnh, oxi hóa được hầu hết kim loại và giải phóng khí (các sản phẩm khử khác nhau của S+6)
H2SO4 đặc có tính háo nước, nên cacbohidrat tác dụng với H2SO4 đặc bị biến thành cacbon (than).
- Tiến hành TN:
+ Lắp dụng cụ điều chế H2S từ FeS và HCl như hình vẽ
+ Đốt khí H2S thoát ra từ ống vuốt nhọn.

- Hiện tượng: Có bọt khí mùi trứng thối thoát ra. Đốt khí thoát ra thấy cháy trong không khí cho ngọn lửa màu xanh.
PTHH: FeS + 2HCl → FeCl2 + H2S
2H2S + O2 → 2S + 2H2O
H2S: là chất khử
O2: là chất oxi hóa.
- Giải thích: H2S bị oxi hóa trong khí bởi oxi.
2. Thí nghiệm 2: Điều chế và chứng minh tính chất hóa học của lưu huỳnh đioxit
- Tiến hành TN: Lắp dụng cụ điều chế SO2 từ Na2SO3 và dung dịch H2SO4 như hình vẽ

+ Thí nghiệm chứng minh tính khử: Dẫn khí SO2 vào ống 1 chứa dung dịch KMnO4 loãng
+ Thí nghiệm chứng minh tính oxi hóa: Dẫn khí H2S (điều chế ở TN1) vào ống 2 chứa nước được dd H2S.
Sau đó dẫn khí SO2 và dd H2S.
- Hiện tượng:
+ Ống 1: Khí SO2 làm mất màu thuốc tím.
PTHH: 2KMnO4 + 5SO2 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4
KMnO4: chất oxi hóa
SO2: chất khử
+ Ống 2: Có hiện tượng vẩn đục, màu vàng do phản ứng tạo S.
PTHH: SO2 + H2S → 3S + 2H2O
SO2: chất oxi hóa
H2S: chất khử
- Giải thích:
SO2 vừa thể hiện tính khử vừa thể hiện tính oxi hóa.
3. Thí nghiệm 3: Tính oxi hóa và tính háo nước của axit sunfuric đặc.
- Tiến hành TN:
+ Thí nghiệm thể hiện tính oxi hóa: Nhỏ vài giọt H2SO4 đặc vào ống 1, cho tiếp 1 mảnh Cu vào ống nghiệm, đun nóng nhẹ trên ngọn lửa đèn cồn.
+ Thí nghiệm thể hiện tính háo nước: Cho 1 thìa nhỏ đường vào ống 2. Nhỏ vài giọt H2SO4 đặc vào ống nghiệm

- Hiện tượng:
+ Ống 1: dung dịch có bọt khí và từ không màu chuyển sang màu xanh.
PTHH: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Cu: là chất khử
H2SO4 đặc: là chất oxi hóa
+ Ống 2: Phản ứng tạo chất rắn màu đen không tan là cacbon, có hiện tượng sủi bọt khí trào ra do C bị oxi hóa bởi H2SO4 đặc tạo CO¬2 và SO2
PTHH: C12H22O11 -H2SO4đặc→ 11H2O + 12C
C + 2H2SO4 → CO2 + 2SO2 + 2H2O
C: chất khử
H2SO4: chất oxi hóa
- Giải thích: H2SO4 đặc có tính oxi hóa mạnh, oxi hóa được hầu hết kim loại và giải phóng khí (các sản phẩm khử khác nhau của S+6)
H2SO4 đặc có tính háo nước, nên cacbohidrat tác dụng với H2SO4 đặc bị biến thành cacbon (than).
Rất tiếc, câu hỏi này chưa có lời giải chi tiết. Bạn ơi, đăng nhập và giải chi tiết giúp zix.vn nhé!!!