Câu hỏi: Để đốt cháy hoàn toàn một lượng chất hữu cơ A phải dùng vừa hết 3,08 lít \({O_2}\). Sản phẩm thu được chỉ gồm có 1,80 g H2O và 2,24 lít CO2. Các thể tích khí đo ở đktc.
1. Xác định công thức đơn giản nhất của A.
2. Xác định công thức phân tử của A, biết rằng tỉ khối hơi của A đối với oxi là 2,25.
3. Xác định công thức cấu tạo có thể có của chất A, ghi tên tương ứng, biết rằng A là hợp chất cacbonyl.
1. Xác định công thức đơn giản nhất của A.
2. Xác định công thức phân tử của A, biết rằng tỉ khối hơi của A đối với oxi là 2,25.
3. Xác định công thức cấu tạo có thể có của chất A, ghi tên tương ứng, biết rằng A là hợp chất cacbonyl.
Phương pháp giải
1. +) Áp dụng ĐLBTKL, tính \({m_A} = {m_{C{O_2}}} + {m_{{H_2}O}} - {m_{{O_2}}}\)
+) Tính khối lượng C, H, O có trong A.
+) Lập tỉ lệ các nguyên tố C, H, O => CTĐGN
2. Tính phân tử khối của A dựa vào tỉ khối hơi
3. Viết CTCT và gọi tên A.
Lời giải chi tiết
1. Theo định luật bảo toàn khối lượng :
\({m_A} = {m_{C{O_2}}} + {m_{{H_2}O}} - {m_{{O_2}}} = \dfrac{{2,24}}{{22,4}}. 44 + 1,8 - \dfrac{{3,08}}{{22,4}}. 32\) = 1,8 (g)
Khối lượng C trong 1,8 g A là : \(\dfrac{{12.2,24}}{{22,4}}\) = 1,2 (g).
Khối lượng H trong 1,8 g A là : \(\dfrac{{2.1,8}}{{18}}\) = 0,2 (g).
Khối lượng O trong 1,8 g A là : 1,8 - 1,2 - 0,2 = 0,4 (g).
Công thức chất A có dạng CxHyOz :
x : y : z = \(\dfrac{{1,2}}{{12}}:\dfrac{{0,2}}{1}:\dfrac{{0,4}}{{16}}\) = 0,1 : 0,2 : 0,025 = 4:8:1
CTĐGN là C4H8O
2. MA = 2,25.32 = 72 (g/mol)
\(\Rightarrow \) CTPT trùng với CTĐGN : C4H8O.
3. Các hợp chất cacbonyl C4H8O :
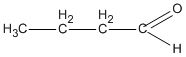 (butanal)
(butanal)
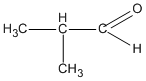 (2-metylpropanal)
(2-metylpropanal)
 (butan-2-ol)
(butan-2-ol)
1. +) Áp dụng ĐLBTKL, tính \({m_A} = {m_{C{O_2}}} + {m_{{H_2}O}} - {m_{{O_2}}}\)
+) Tính khối lượng C, H, O có trong A.
+) Lập tỉ lệ các nguyên tố C, H, O => CTĐGN
2. Tính phân tử khối của A dựa vào tỉ khối hơi
3. Viết CTCT và gọi tên A.
Lời giải chi tiết
1. Theo định luật bảo toàn khối lượng :
\({m_A} = {m_{C{O_2}}} + {m_{{H_2}O}} - {m_{{O_2}}} = \dfrac{{2,24}}{{22,4}}. 44 + 1,8 - \dfrac{{3,08}}{{22,4}}. 32\) = 1,8 (g)
Khối lượng C trong 1,8 g A là : \(\dfrac{{12.2,24}}{{22,4}}\) = 1,2 (g).
Khối lượng H trong 1,8 g A là : \(\dfrac{{2.1,8}}{{18}}\) = 0,2 (g).
Khối lượng O trong 1,8 g A là : 1,8 - 1,2 - 0,2 = 0,4 (g).
Công thức chất A có dạng CxHyOz :
x : y : z = \(\dfrac{{1,2}}{{12}}:\dfrac{{0,2}}{1}:\dfrac{{0,4}}{{16}}\) = 0,1 : 0,2 : 0,025 = 4:8:1
CTĐGN là C4H8O
2. MA = 2,25.32 = 72 (g/mol)
\(\Rightarrow \) CTPT trùng với CTĐGN : C4H8O.
3. Các hợp chất cacbonyl C4H8O :